En apenas 5 años (los primeros experimentos que demostraban su uso como editores genéticos aparecieron en enero de 2013) las herramientas #CRISPR han revolucionado los laboratorios de todo el mundo. Voy a intentar explicar por qué, de forma resumida. Vamos con el prometido HILO:
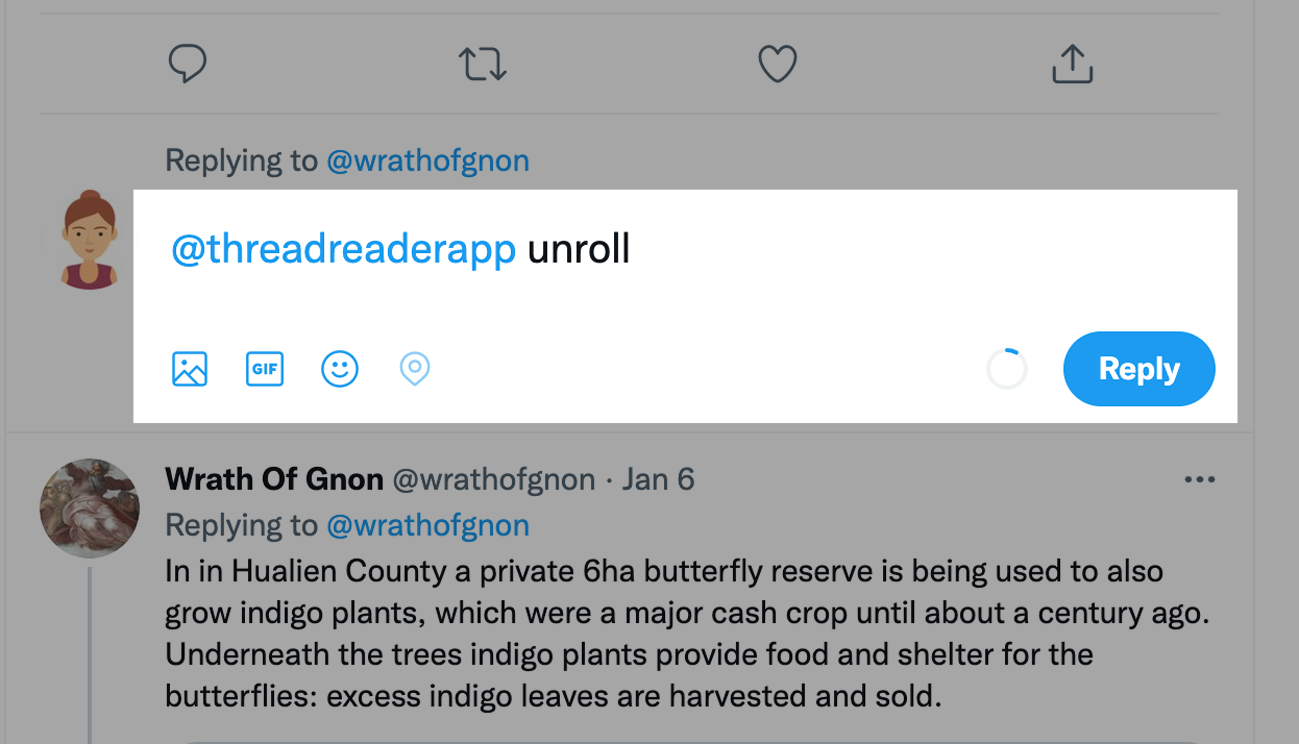
Voy a empezar por el final. Lo que hace a las #CRISPR unas herramientas sorprendentes es su aparente facilidad para promover cambios en el genoma, en el material genético de cualquier organismo. Recordemos que el ADN está formado por cadenas de letras (nucleótidos) A, T, G y C
El ADN es una doble cadena. La A siempre se empareja con la T, y la G con la C. Cada organismo tiene un número de letras específico. Nosotros tenemos aproximadamente 3.000 millones de letras. Por el contrario una bacteria como Escherichia coli tiene apenas 3 millones de letras. 
En estos 3000 millones de letras tenemos los aproximadamente 20.000 genes que necesitamos para funcionar (aunque apenas ocupan un 2% del total). Muchos de ellos dejan de hacerlo si presentan alguna mutación, algún cambio en su secuencia que determina la pérdida de la función.
Esta es la causa de muchas enfermedades de base genética, congénitas, como las >7.000 enfermedades raras conocidas. Nos encantaría poder investigarlas, en modelos celulares o animales, y, claro, tratarlas o curarlas. Para ello necesitamos PRECISIÓN. La que nos dan las #CRISPR
Necesitamos precisión para alterar la secuencia de un gen determinado y estudiar los efectos de una mutación en modelos experimentales. Y, claro, necesitamos la precisión para desarrollar nuevas terapias génicas avanzadas que corrijan el gen anómalo, dejando intactos los demás.
Desde hace casi 40 años conocemos técnicas que permiten modificar el genoma de organismos, prácticamente a voluntad. Pero lo que siempre nos ha costado mucho ha sido desarrollar métodos de PRECISIÓN eficaces y asequibles, que permitan alterar un gen determinado de forma sencilla.
En general la modificación precisa de un gen (por un proceso denominado de recombinación homóloga, basado en la "homología"= similitud de secuencias) ocurre en células animales con una frecuencia bajísima, solo 1 de cada 10,000 a 1.000.000 de células. Factible pero poco práctica.
Aquí entran de nuevo las #CRISPR en juego. No solamente nos aportan PRECISIÓN sino que AUMENTAN de forma muy considerable la frecuencia de modificación genética del gen seleccionado, hasta 1 de cada 10 células, un 10%, aumentando por lo menos en >1000 veces esa probabilidad.
Todavía no sabemos cómo funcionan ni de dónde vienen pero por lo menos, con estas dos propiedades espectaculares de las #CRISPR (precisión y aumento de probabilidad de modificación) ya podemos intuir por qué todos los genetistas y biólogos moleculares andamos como locos con ellas
El origen de las #CRISPR hay que buscarlo en microorganismos aparentemente más simples que nosotros: los procariotas (las bacterias y las arqueas), pero que sin embargo llevan sobre la Tierra miles de millones de años, muchísimos más que nosotros, que apenas llevamos 2 ó 3 aquí. 
El origen de las #CRISPR tiene acento español. Preguntaros dónde estabais hace 25 años? Francisco Juan Martínez Mojica (Francis Mojica) microbiólogo de @UA_Universidad acababa de publicar su primer artículo sobre las #CRISPR investigando las arqueas de las salinas de Santa Pola, 

Podéis consultar esta entrevista que le hizo @manuelansede a Francis Mojica para @elpaissemanal donde explica los orígenes de las #CRISPR y donde podréis ver el color rosado de las salinas, causado por las arqueas que allí habitan y que estudiaba Francis elpais.com/elpais/2017/05…
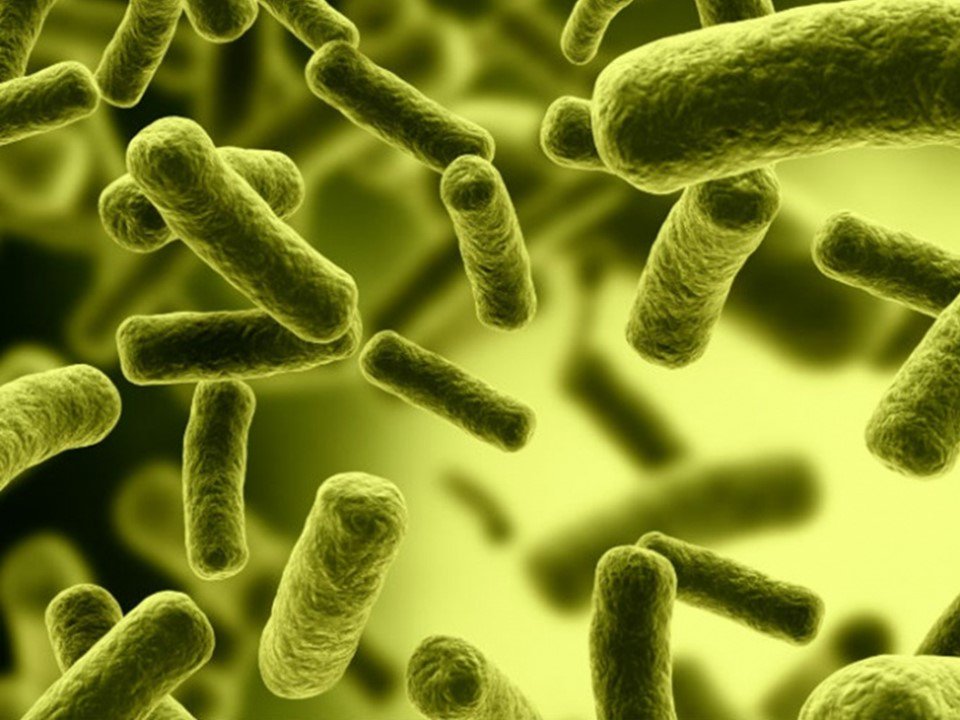
Francis Mojica y sus colaboradores descubrieron en el genoma de las arqueas de Santa Pola unas secuencias de letras que se repetían (rombos en el dibujo). Esto fue en 1993. Fueron los primeros en describirlas en arqueas, pero no los primeros en describirlas en las bacterias. 
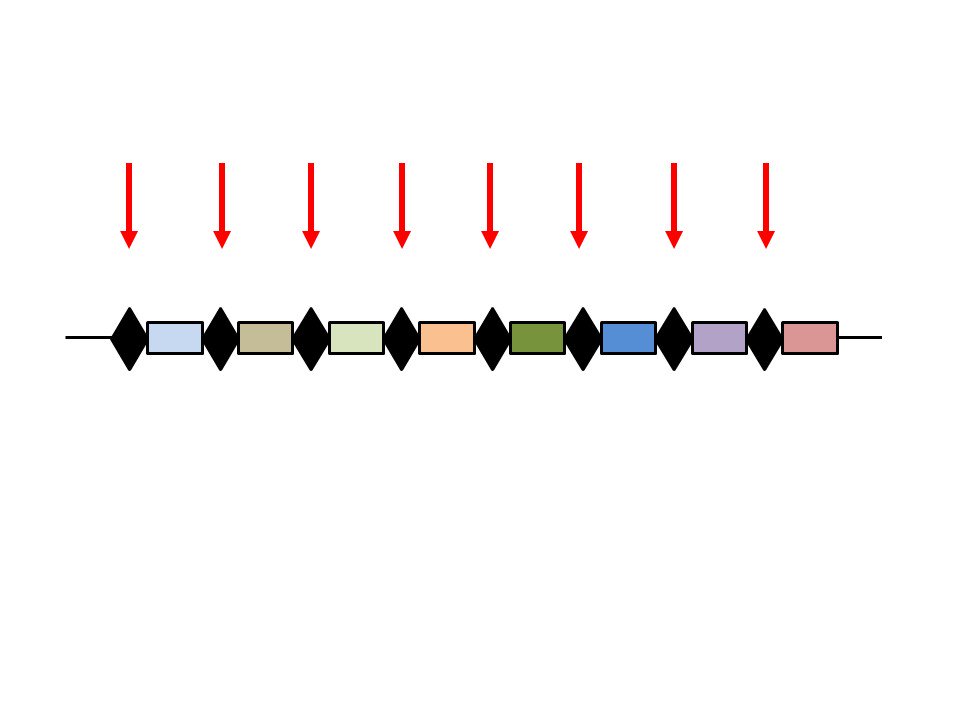
Antes que ellos en Alicante, microbiólogos japoneses (en 1987) y holandeses (en 1991) habían descrito repeticiones parecidas en dos tipos de bacterias muy distintas, las gram positivas y gram negativas, y muy distintas a su vez de las arqueas. Todos procariotas pero diferentes.
Pero Francis Mojica, a diferencia de sus colegas japoneses y holandeses, se percató de que unas repeticiones parecidas en el genoma de estos microorganismos tan distintos (como un champiñón de una jirafa) solo podía indicar que era algo importante, heredado de ancestros comunes.
Y decidió dedicar el resto de su vida profesional a investigarlas, a tratar de entenderlas. Y, por eso, entre otras cosas, estamos hoy aquí comentando en este hilo las sorprendentes propiedades de las #CRISPR, derivadas de las bacterias pero extraordinariamente útiles a todos.
Francis Mojica puso nombre en 2001 a estas repeticiones tras descubrirlas en muchas bacterias y arqueas. Las llamó "Repeticiones cortas palíndrómicas agrupadas y regularmente espaciadas", cuyas siglas en inglés corresponden a la palabra más famosa actualmente en ciencia: #CRISPR
En 2003 Francis Mojica fue el primero en percatarse de cuál podría ser la función de las #CRISPR en bacterias y arqueas. En lugar de fijarse en las secuencias repetidas se fijó en lo que había entre ellas, y descubrió que eran fragmentos del genoma de virus que atacan a bacterias
Y entonces llegó su principal momento Eureka! F. Mojica no solo descubrió que las secuencias espaciadoras derivaban del genoma de virus sino que se percató que aquellas bacterias que las portaban eran inmunes a esos mismos virus. Había descubierto un sistema inmune adaptativo! 
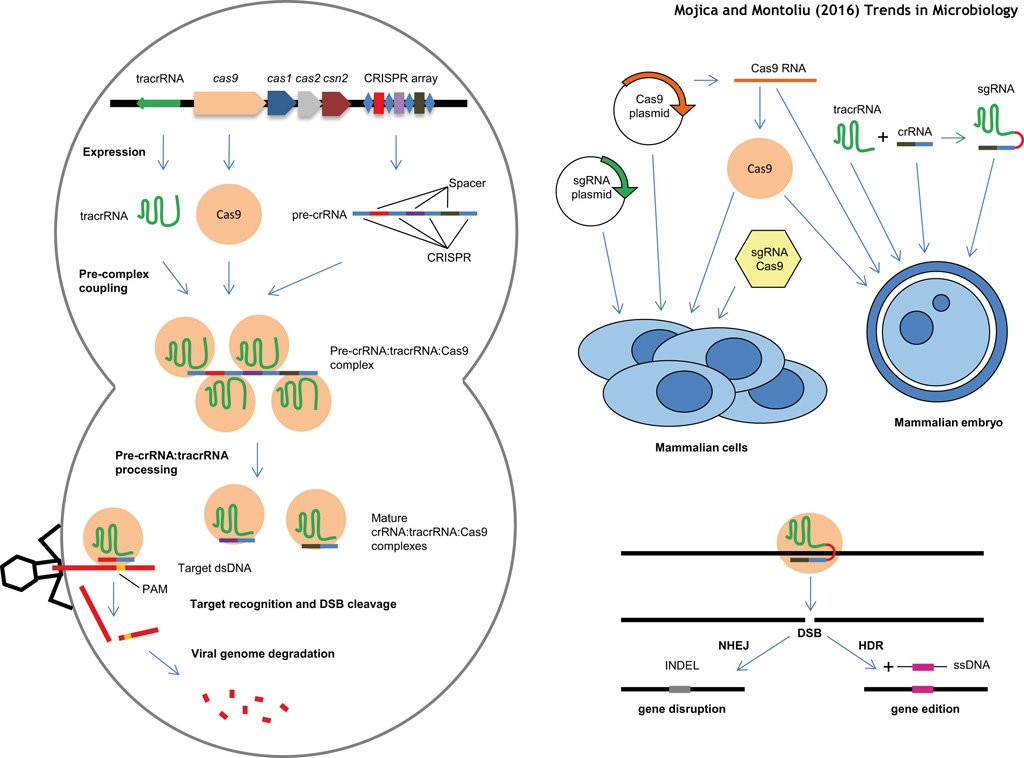
Tardó casi 3 años en publicar sus resultados, que fueron rechazados por gran parte de la comunidad científica. Su artículo apareció publicado en la revista Journal of Molecular Evolution en 2005. Una revista digna pero fuera de los focos. Pero un artículo que le puso en el mapa.
Tras su hallazgo otros investigadores descubrieron y describieron los componentes del sistema #CRISPR y con el tiempo se conoció cómo funcionaban. Estos son los 12 investigadores que yo destaco en la página web que mantengo sobre #CRISPR en el @CNB_CSIC wwwuser.cnb.csic.es/~montoliu/CRIS… 

Los 4 primeros descubrieron el sistema inmune adaptativo #CRISPR en bacterias. Los 4 del medio describieron sus componentes y propusieron (Charpentier/Doudna/Siksnys) su uso como editores génicos. Los 4 últimos demostraron que con el sistema CRISPR era posible para editar genomas
La historia del origen de las #CRISPR como sistema inmune en bacterias y arqueas, la descripción de todos sus componentes y su conversión en herramientas de edición genética la contamos Francis Mojica y yo en una revisión conjunta en @TrendsMicrobiol ncbi.nlm.nih.gov/pubmed/27401123 
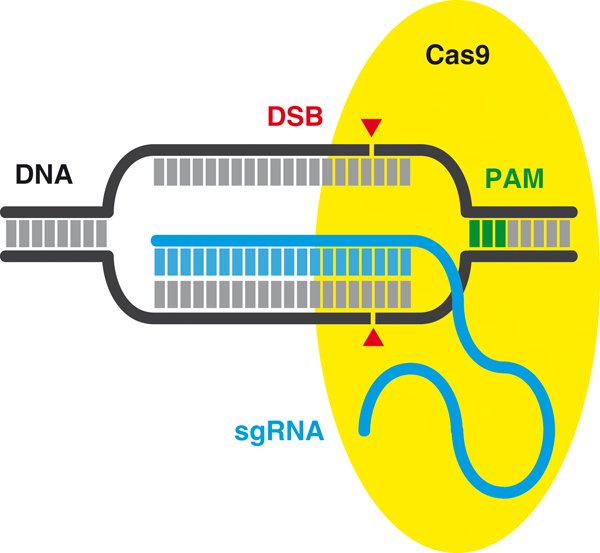
El sistema #CRISPR está formado por una proteína que corta generalmente ADN (una endonucleasa, Cas9) y por una molécula guía de ARN (sgRNA) que le indica a la proteína dónde cortar. Por eso se llaman nucleasas programables o tijeras moleculares, porque cortan ADN con precisión 
Apenas bastan 20 letras para dirigir el corte de la nucleasa Cas9 (la tijera) a un gen determinado. Doudna y Charpentier propusieron unir las dos pequeñas moléculas de ARN en una sola, que llamaron guía (sgRNA) pero actualmente hemos vuelto a usar los dos componentes originales 
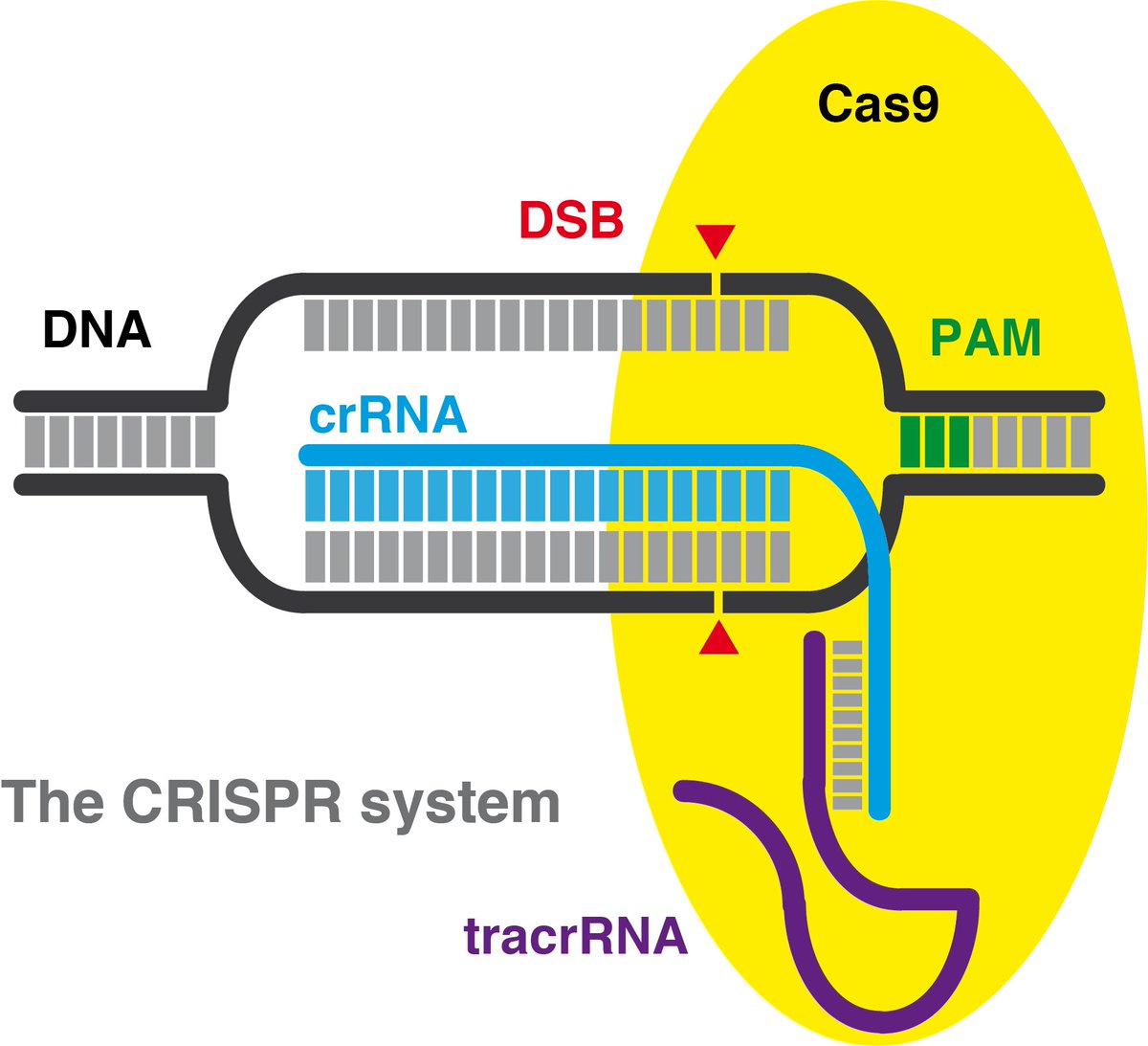
Hoy usamos RNPs (ribonucleoproteínas) formadas por una molécula de la nucleasa (generalmente Cas9), una molécula de ARN que dirige el corte a un gen determinado (crRNA) y otra molécula de ARN, común, que une la primera a la Cas9 (tracrRNA). Todos los reactivos ya son comerciales.
Si hablamos de tijeras moleculares es porque las #CRISPR cortan el ADN. Esencialmente eso es lo único que hacen (pero recordemos que lo hacen muy bien, con precisión y alta probabilidad). Entonces, si solamente cortan el ADN, por qué tanto revuelo con ellas para editar genomas ? 

El corte en el ADN que provocan las #CRISPR debe repararse de inmediato. Es una agresión que las células, todas las células, reparan raudamente. No pueden exponerse a perder un fragmento del cromosoma en la siguiente división celular. Por eso, tras el corte, entran en juego otros 
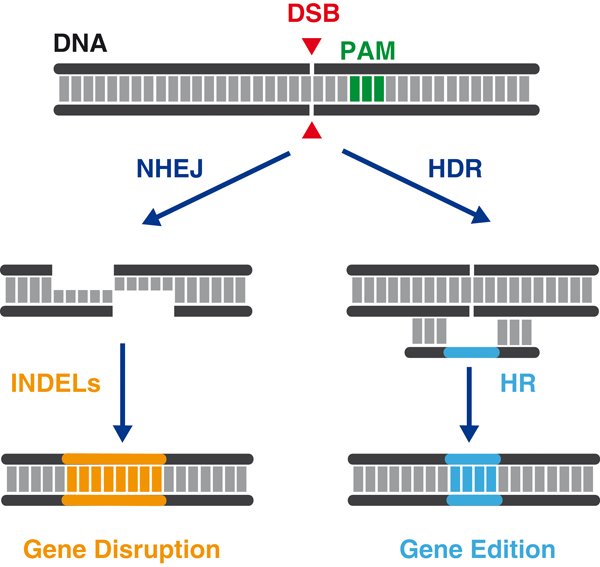
El corte en la doble cadena (DSB en inglés) activa dos sistemas de reparación. El que funciona siempre es que yo llamo de cremallera o "velcro". Con él se intenta INsertar y DELecionar letras hasta conseguir aparear las dos cadenas de nuevo, y luego rellenar y restaurar el ADN.
Al haber INsertado y DELecionado (INDELs) letras la secuencia del gen se habrá alterado y habitualmente esta reparación provoca la inactivación del gen. Pero fijémonos. Nunca antes fue tan sencillo inactivar un gen. Tan solo hemos dirigido el corte con las #CRISPR al gen deseado
Podemos también añadir un molde al sistema, otra secuencia de ADN que comparta homología alrededor del corte pero que aporte secuencias nuevas, que no estaban antes. Así conseguiremos reparar el corte de ADN e introducir secuencias nuevas, es decir, podremos EDITAR el gen.
Yendo por la vía cremallera-velcro o la vía de la edición-substitución lo cierto es que las #CRISPR cortan el ADN y activan los sistemas de reparación que son los responsables de que podamos ahora insertar, delecionar, substituir, duplicar, invertir, reordenar, ... secuencias.
Mediante las herramientas #CRISPR podemos virtualmente realizar prácticamente cualquier modificación que deseemos en los genomas, tanto para estudiar y reproducir las mutaciones que vemos en pacientes como para corregirlas, primero en modelos animales, y luego en las personas.
Evidentemente las cosas siempre son siempre más complicadas. La precisión de las #CRISPR no es infalible. Pueden equivocarse y cortar en secuencias parecidas. Y los sistemas de reparación cometen también errores. Corrigen los cortes de múltiples maneras, incluida la que deseamos.
También recientemente hemos descubierto que las proteínas Cas9 derivadas de bacterias pueden ser conocidas por nuestro sistema inmune, por lo que cualquier intento de usarlas en terapia podría generar una reacción en contra. Lo conté en @Naukas_com naukas.com/2018/01/07/ine…
En resumen, las herramientas #CRISPR son sorprendentes y nos permiten realizar una edición de genes y genomas con una precisión y probabilidad hasta ahora desconocidas. Pero todavía no las controlamos del todo. Hace falta seguir investigando para aumentar seguridad y eficacia.
Termino con este mensaje este hilo sobre los orígenes de las herramientas #CRISPR sobre qué son y cómo funcionan y cómo hemos logrado convertirlas en verdaderos editores de genomas. Dejo para otros hilos futuros comentar las diversas aplicaciones que hay hoy en día. FIN DEL HILO
• • •
Missing some Tweet in this thread? You can try to
force a refresh